पोलोनियम प्रकृति में पाया जाने वाला एक दुर्लभ एवं अत्यधिक रेडियोएक्टिव रासायनिक तत्व है जो Po के चिन्ह द्वारा दर्शाया जाता है और इसकी परमाणु संख्या 34 है। पोलोनियम की विरलता का पता इसी से लगाया जा सकता है कि यूरेनियम अयस्क के प्रति मीट्रिक टन में इसकी मात्रा करीब 100 ग्राम होती है। प्रकृति में जितनी रेडियम की मात्रा होती है, उसकी लगभग 0.2 प्रतिशत मात्रा पोलोनियम की होती है। ऐलेक्जैंडर लिट्विनेनको रूसी खुफिया ऐजेंसी (पहले केजीबी और अब एफएसबी) के एक बड़े अधिकारी थे, जिन्होंने रूसी खुफिया एजेंसी के कार्य करने के तरीके पर विरोध जताया और इस कारण उन्हें रूस से भागकर, ब्रिटेन में शरण लेनी पड़ी। वहां पर भी उन्होंने रूसी सरकार और खासतौर से रूसी राष्ट्रपति पुतिन के खिलाफ अपनी लड़ाई जारी रखी और खुफ़िया एजेंसी की हरकतों के खिलाफ पुस्तकें भी लिखीं। उनकी इस कार्य में हर संभव मदद, रूसी पूंजीपति बोरिस बेरोजोविस्की ने की, जो पहले से इंग्लैंड की शरण में थे।
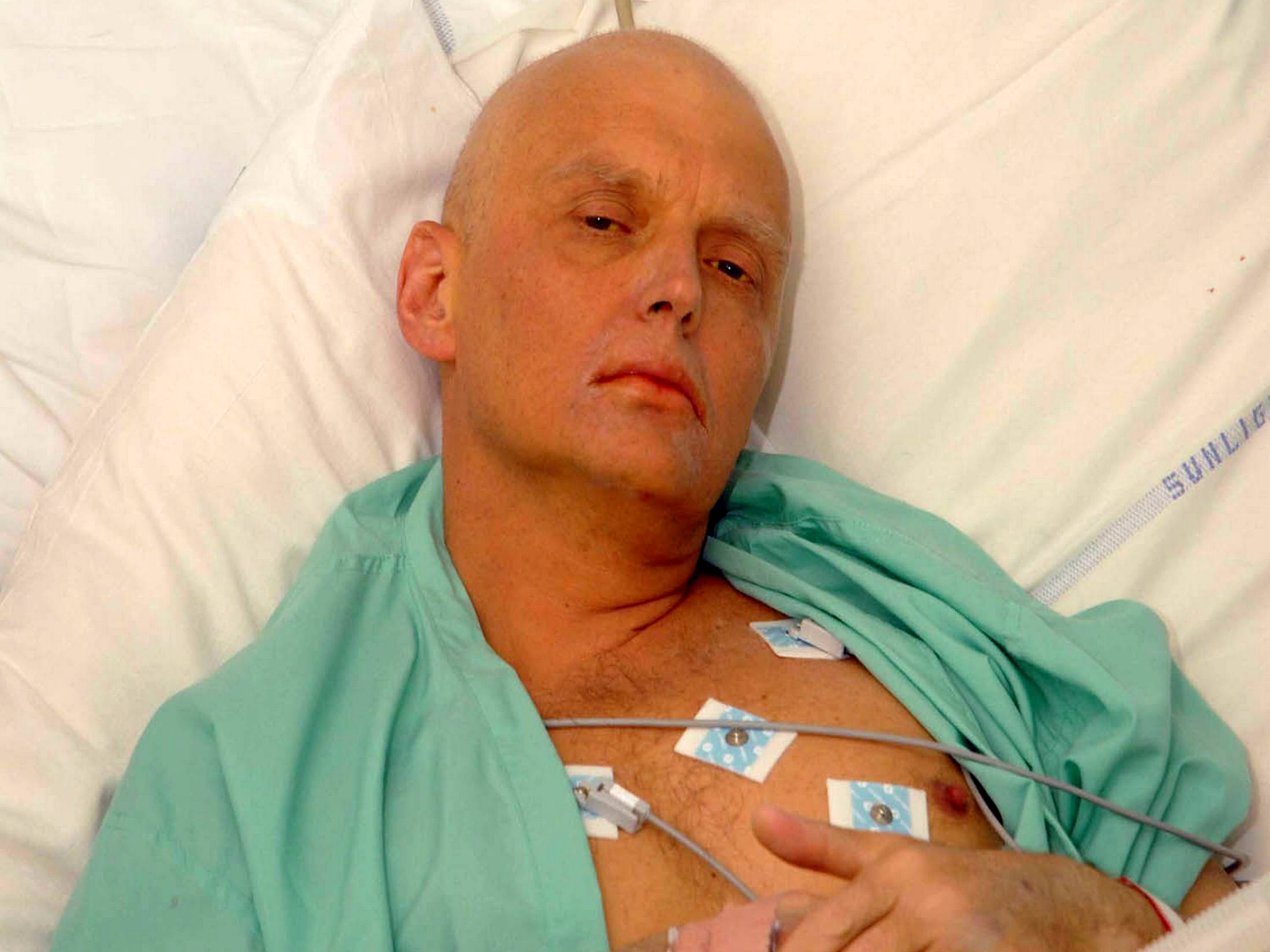
लिट्विनेनको ने 1 नवंबर को एक जापानी रेस्त्रां में एक इतालवी व्यक्ति मारियो स्कारामैला के साथ खाना खाया और फिर अचानक उनकी तबियत खराब हो गई। 44 वर्षीय लिट्विनेनको की पत्नी मरीना रो अपने पति को तिल-तिल कर मरते हुए देख रही थी। हर इलाज बेकार था और हर 24 घंटे उसके पति की आयु दस वर्ष बढ़ा रहे थे। लिट्विनेनको के सर पर अब सुनहरे बाल नहीं थे, यहां तक कि भौंहें भी कम होती जा रहीं थी। न दर्द, न जख्म न कोई संक्रमण, बस धीरे-धीरे मौत की तरफ बढ़ता जीवन। पूरा शरीर एक 44 वर्ष के स्वस्थ व्यक्ति का न होकर करीब 100 साल के जर्जर व्यक्ति का लग रहा था और फिर तीन हफ्ते की असफल जंग के बाद एलेक्जैंडर लिट्विनेनको ने 23 नवंबर, 2006 को मौत के सामने हथियार डाल दिए। डॉक्टरों के अनुसार लिट्विनेनको रेडियोएक्टिव (रेडियोधर्मी) तत्व पोलोनियम 210 की विषाक्तता से ग्रस्त थे। स्कारामैला में भी रेडियोएक्टिविटी की विषाक्तता के लक्षण मिले हैं। वह भी अस्पताल में भर्ती हैं, अगर बच गए तो कैंसर होने की काफी संभावना है। इसके अलावा लिट्विनेनको की पत्नी मरीना में भी पोलोनियम के ट्रेस मिले पर उनके शरीर में घातक मात्रा नहीं है। इसके अलावा लिट्विनेनको के घर, उस होटल में जहां उनकी दो रूसियों से मुलाकात हुई थी, जापानी रेस्त्रां में बोरिस बेरोजविक्सी के दफ्तर में ग्रॉसवेनर स्ट्रीट स्थित सुरक्षा मुख्यालय में भी पोलोनियम 210 के विकिरण के प्रमाण मिले हैं।
चार हवाई जहाजों में भी पोलोनियम 210 होने के प्रमाण मिले हैं, जिनमें करीब 33 हजार व्यक्ति यात्रा कर चुके हैं। इन जहाजों को अब उड़ाया नहीं जा रहा और सभी यात्रियों का पता लगाकर उनकी जांच की जा रही है।
एलेक्जैंडर लिट्विनेनको को मौत की नींद सुलाने वाला जहर, पोलोनियम-210 (210 Po) की पहचान ब्रिटिश चिकित्सकों ने कर ली थी। पर फिर भी, उसके खतरनाक विकिरण को रोक पाने में वह असफल रहे।
पोलोनियम को शुरुआत में ‘रेडियम एफ’ नाम दिया गया था और इसकी खोज मशहूर वैज्ञानिक और नोबल पुरस्कार विजेता दंपति मैरी क्यूरी और उनके पति पियरे क्यूरी ने सन् 1898 में की थी। मैरी क्यूरी मूलतः पोलैंड की निवासी थीं और जब पोलोनियम की खोज हुई थी तो उस समय पोलैंड, रूस, पुरुशियाई, और आस्ट्रिया के कब्ज़े में था। इसलिए मैरी क्यूरी ने सोचा कि अगर इस तत्व का नाम उनके देश पोलैंड के नाम पर रख दिया जाएगा तो शायद दुनिया का ध्यान पोलैंड की गुलामी की ओर जाएगा। इस कारण इस नए खोजे गए तत्व का नाम ‘रेडियम एफ’ से बदलकर पोलैंड के सम्मान में ‘पोलोनियम’ रखा और प्रथम विश्व युद्ध के बाद सन् 1918 में पोलैंड एक आजाद देश बन गया।
इस तत्व की खोज तब हुई, जब क्यूरी दंपति पिचब्लेंड (खोदने पर मिली पथरीली सामग्री) की रेडियोएक्टिविटी (रेडियोधर्मिता) पर शोध कर रहे थे। उन्होंने पाया कि पिचब्लेंड में से दोनों रेडियोएक्टिव पदार्थ यानी यूरेनियम और थोरियम, अलग करने के बावजूद भी पिचब्लेंड, यूरेनियम और थोरियम से ज्यादा रेडियोएक्टिव था। इस नतीजे ने क्यूरी दंपति को और रेडियोएक्टिव तत्वों की खोज करने के लिए प्रेरित किया और इन्होंने पिचब्लेंड से पहले पोलोनियम और इसके कुछ वर्ष बाद रेडियम पृथक किया।
अल्फा विकिरण एक उच्च आयनीकृत कणों का विकिरण होता है, जिसकी भेदने की क्षमता सबसे कम होती है। अल्फा कणों में दो प्रोटोन और दो न्यूट्रॉन होते हैं, जो हीलियम के नाभिक जैसे कण में आपस में जुड़े होते हैं, इसलिए इन्हें He2+ लिखा जाता है। परमाणु की परमाणविक संख्या 2 के अनुसार कम हो जाती है क्योंकि परमाणु से 2 प्रोटोन निकल जाते हैं और नए तत्व का निर्माण होता है, उदाहरण के लिए अल्फा विघटन के कारण रेडियम, रोडोन गैस बन जाता है। अल्फा कणों की गति ज्यादा नहीं होती बल्कि सभी सामान्य प्रकार के विकरण में सबसे कम होती है क्योंकि इनका द्रव्यमान ज्यादा होता है यानी ज्यादा ऊर्जा अपने चार्ज (आवेश) और बड़े द्रव्यमान के कारण इन्हें एक पतला टिशू पेपर या फिर मानव शरीर की बाह्य त्वचा भी आसानी से अवशोषित कर सकते हैं। इसीलिए अल्फा उत्सर्जकों का फेफड़ों या शरीर में अवशोषित होना या खाने के साथ शरीर में जाना काफी खतरनाक होता है। बीटा विकिरण में इलेक्ट्रॉन होते हैं, जो एल्यूमीनियम प्लेट से रोके जा सकते हैं। गामा विकिरण और अंदर तक भेद सकते हैं। बीटा कण, पोटैशियम-40 जैसे कुछ रेडियोएक्टिव नाभिक से उत्सर्जित होते हैं जो उच्च ऊर्जा, उच्च गति वाले इलेक्ट्रॉन या पोजीट्रॉन होते हैं।
पोलोनियम प्रकृति में पाया जाने वाला एक दुर्लभ एवं अत्यधिक रेडियोएक्टिव (रेडियोधर्मी) रासायनिक तत्व है जो Po के चिन्ह द्वारा दर्शाया जाता है और इसकी परमाणु संख्या 34 है। पोलोनियम की विरलता का पता इसी से लगाया जा सकता है कि यूरेनियम अयस्क के प्रति मीट्रिक टन में इसकी मात्रा करीब 100 ग्राम होती है। प्रकृति में जितनी रेडियम की मात्रा होती है, उसकी लगभग 0.2 प्रतिशत मात्रा पोलोनियम की होती है।
किसी भी ज्ञात तत्व में सर्वाधिक आइसोटोप यानी समस्थानिक, पोलोनियम के हैं और पोलोनियम के सभी आइसोटोप रेडियोएक्टिव हैं। पोलोनियम के 25 ज्ञात आइसोटोप हैं। इनमें 210Po यानी पोलोनियम 210, सबसे ज्यादा उपलब्ध है।
पोलोनियम 210 की हाफ लाइफ यानी अर्ध आयु (वह अवधि, जिसमें तत्व अपनी रेडियोधर्मिता की आधी क्षमता खो देता है), लगभग 138 दिनों की होती है। इसी तरह, पोलोनियम 209 (209Po) की अर्ध आयु 103 वर्ष तथा पोलोनियम 208 (208Po) की अर्ध आयु 2.9 वर्षों की होती है। पोलोनियम 209 और 208 को सीसे (Pb) या बिस्मथ (Bi) पर अल्फा, प्रोटॉन या ड्यूट्रॉन की साइक्लोट्रॉन में बारिश द्वारा भी बनाया जा सकता है। साइक्लोट्रॉन एक ऐसा उपकरण है जो परमाणविक कणों की गति बढ़ा सकता है यानी साइक्लोट्रॉन के उपयोग द्वारा बिस्मथ पर प्रोटॉन की बारिश करवा कर ज्यादा आयु वाले पोलोनियम के आइसोटोप बनाए जा सकते हैं।
1934 में अमेरिका में किए गए एक प्रयोग से यह सामने आया कि जब प्राकृतिक बिस्मथ (209Bi) पर न्यूट्रॉन की बारिश की जाती है तो 210Bi यानी बिस्मथ 210 बन जाता है, जो बीटा क्षय के कारण 210Po यानी पोलोनियम 210 में परिवर्तित हो जाता है। इस विधि द्वारा भी ‘न्यूक्लियर रिएक्टरों’ में पाए जाने वाले न्यूट्रॉन प्रवाह से भी कुछ मि.ग्रा. मात्रा में ही पोलोनियम तैयार किया जाने लगा है। हर वर्ष करीब 100 ग्राम पोलोनियम का उत्पादन किया जाता है, जिस कारण बहुत ही दुर्लभ तत्वों में इसकी गिनती होती है।
पोलोनियम 210 से असंख्य अल्फा कण निकलते हैं, जो किसी भी गाढ़े माध्यम में थोड़ी ही दूरी तक जा पाते हैं और रुकते ही यह अल्फा कण अपने में समाई ऊर्जा छोड़ देते हैं। पोलोनियम 210 के क्षय से इतनी ज्यादा ऊष्मा निकलती है (140 वाट प्रति ग्राम) की एक साधारण से दवाई वाले कैप्सूल में अगर आधा ग्राम पोलोनियम 210 भर दिया जाए तो इसका तापमान 500 डिग्री सेंटीग्रेड से भी ज्यादा पहुंच जाएगा। अपने इसी गुण के कारण पोलोनियम 210 का उपयोग एक हल्के ऊष्मा के स्रोत के रूप में कृत्रिम उपग्रह के ताप विद्युतीय सैलों में किया जाता है। चंद्रमा की सतह पर गए प्रत्येक लूनोखोड रोवर में पोलोनियम 210 को ऊष्मा के स्रोत के रूप में रखा गया था, जिसका काम चंद्रमा की ठंडी रातों में रोवर के अंदरूनी उपकरणों को गर्म रखना था। क्योंकि अल्फा कण पॉजिटिव चार्ज कण होते हैं, इसलिए पोलोनियम 210 का उपयोग विद्युत स्थैतिक (इलैक्ट्रो स्टेटिक) को निष्क्रिय करने के लिए किया जाता है। कुछ प्रति-स्थैतिक ब्रशों में पोलोनियम 210 की मात्रा 500 माइक्रोक्यूरी तक होती है। उदाहरण के लिए फोटोग्राफिक फिल्मों को डेवलप करने वाली लैब में इन ब्रशों का उपयोग किया जाता है। इसी तरह कपड़ा उद्योग, स्टील रोलिंग मिल्स आदि में भी पोलोनियम का उपयोग प्रति-स्थैतिक के रूप में किया जाता है।
1960 के दशक में एक अध्ययन से यह सामने आया कि सिगरेट में पोलोनियम की अच्छी-खासी मात्रा होती है। यूरेनियम के विघटित उत्पाद, प्राकृतिक रूप में मिट्टी में होते हैं, जिन्हें तम्बाकू का पौधा अवशोषित कर लेता है और पौधे में यह उत्पाद रेडियोएक्टिव पोलोनियम में विघटित हो जाते हैं। जिन क्षेत्रों में उच्च फास्फेट वाली खाद का अधिक प्रयोग होता है वहां यह परेशानी ज्यादा है क्योंकि खाद में मौजूद फास्फेट से यूरेनियम का ज्यादा जुड़ाव है। एक अनुसंधान से यह पता चला है कि सिगरेट का सेवन करने वाले लोग, औसतन 0.04 पिकोक्यूरी पोलोनियम 210 प्रति सिगरेट अपने में समा लेते हैं। इसके अलावा सिगरेट के हर कश के साथ टार, तम्बाकू, साइनाइड और कैंसर पैदा करने वाले बेंजोपाइरीन जैसे 100 से भी ज्यादा खतरनाक रसायन होते हैं। सिगरेट पीने वालों के द्वारा छोड़े गए धुएं से उनके साथ-साथ न पीने वाले भी प्रभावित होते हैं, शायद कुछ ज्यादा ही।
पोलोनियम 210, लगभग 138 दिनों की अर्ध आयु वाला एक जबरदस्त अल्फा उत्सर्जक है। पोलोनियम 210 की एक मि.ग्रा. मात्रा, रेडियम की 5 ग्राम मात्रा में से निकलने वाले अल्फा कणों के बराबर अल्फा कण उत्सर्जित करती है। पोलोनियम की कुछ क्यूरी (1 क्यूरी बराबर 37 गिगाबैक्यूरल) मात्रा एक नीली चमक पैदा करती है, जो आसपास की हवा के उत्तेजित होने से होता है। क्योंकि पोलोनियम 210 की अर्ध आयु काफी कम होती है, इसलिए एक ग्राम पोलोनियम 210 से 140 वाट की ऊर्जा प्राप्त होती है। लगभग सभी अल्फा विकिरण अपने ठोस आवरण में रुक जाते हैं और ऊर्जा छोड़ देते हैं।
तनुकृत अम्लों में पोलोनियम 210 आसानी से घुल जाता है और क्षारीय द्रव्य मे यह मुश्किल से घुल पाता है। पोलोनियम 210 का गलनांक (melting point) काफी कम होता है और यह काफी उड़नशील धातु है। करीब 55 डिग्री सेंटीग्रेड तापमान पर 45 घंटों में 50 प्रतिशत धातु वाष्पित हो जाती है।
 एक अध्ययन में ऐसा भी सामने आया है कि सूक्ष्मजीव भी पोलोनियम को इस्तेमाल करते हैं। इसलिए प्राणियों और वनस्पतियों में भी पोलोनियम मामूली मात्रा में पाया जा सकता है। अगर पोलोनियम के ठोस आकार की चर्चा करें तो यह एक घन के रूप में होता है, जिसमें परमाणुओं के बीच की दूरी 3.352 आर्मस्ट्रांग होती है (परमाणुओं के बीच की दूरी आर्मस्ट्रांग में नापी जाती है)।
एक अध्ययन में ऐसा भी सामने आया है कि सूक्ष्मजीव भी पोलोनियम को इस्तेमाल करते हैं। इसलिए प्राणियों और वनस्पतियों में भी पोलोनियम मामूली मात्रा में पाया जा सकता है। अगर पोलोनियम के ठोस आकार की चर्चा करें तो यह एक घन के रूप में होता है, जिसमें परमाणुओं के बीच की दूरी 3.352 आर्मस्ट्रांग होती है (परमाणुओं के बीच की दूरी आर्मस्ट्रांग में नापी जाती है)।
द्वितीय विश्व युद्ध के दौरान जापान के नागासाकी पर गिराए गए परमाणु बम में ‘ट्रिगर’ के रूप में पोलोनियम 210 का ही उपयोग किया गया था, परंतु इसकी एक नई भूमिका अभी-अभी सामने आई है, यह है ‘जहर’ के रूप में पोलोनियम का उपयोग।
पोलोनियम एक अत्यधिक रेडियोएक्टिविटी वाला और रासायनिक रूप से अत्यधिक विषाक्त तत्व है और इसका सुरक्षित रखरखाव काफी मुश्किल है। पोलोनियम की माइक्रोग्राम (1 ग्रा. का हजारवां हिस्सा) मात्रा को भी सहेजना काफी खतरनाक है। इसके लिए विशेष उपकरणों और सख्त निर्देशका का पालन करना आवश्यक है। पोलोनियम द्वारा उत्सर्जित अल्फा कणों द्वारा जैविक ऊतकों को नुकसान पहुंचाना बहुत आसान है। अगर पोलोनियम का सेवन किया गया हो या सूंघा गया हो या किसी जख्म के द्वारा उसे उवशोषित किया गया हो तो पोलोनियम हमारी त्वचा की बाहरी परत (ऐपिडर्मिस) के पार नहीं जा सकता, क्योंकि इसमें मृत कोशिकाएं होती हैं जो हमारी रक्षा करती हैं।
एक बार अगर पोलोनियम 210 हमारे शरीर में पहुंच गया तो यह अपना खतरनाक रूप दिखाने लगता है। कोशिकाओं के डीएनए में बदलाव, जो कई कैंसरों को जन्म दे सकता है, से लेकर ऊतकों की संरचना तक को भी गड़बड़ा सकता है। अगर पोलोनियम की लगभग 50 नैनोग्राम (1 नैनोग्राम = 1 ग्राम का एक अरबवां हिस्सा यानी 10-9 ग्राम) मात्रा अगर खाई जाए और करीब 10 नैनोग्राम मात्रा सूंघी जाए तो यह जीवन के लिए घातक मात्रा है, जो हर पल मौत की ओर ले जाएगी। इस सिद्धांत को अगर सही मानें तो पोलोनियम 210 की 1 ग्राम मात्रा 10 करोड़ लोगों को अपनी विषाक्तता का शिकार बना सकती है।
हमारे शरीर की पोलोनियम 210 को बर्दाश्त करने की अधिकतम सीमा 0.03 माइक्रो क्यूरी है। इसका मतलब हुआ कि एक ऐसा कण जिसका वजन 6.8x10-12 ग्राम हुआ। अगर वजन के अनुसार लें तो पोलोनियम 210, हाइड्रोसाइनिक एसिड (साइनाइड जो सबसे घातक जहर माना जाता है) से 2.5X10 के पावर 11 गुना (यानी खरबों गुना) ज्यादा विषाक्त है।
पोलोनियम का जहर के रूप में पहली बार उपयोग एलेक्जैंडर लिट्विनेनको पर ही किया गया है, पर पोलोनियम की विषाक्तता की पहली शिकार थी, 1950 के दशक में ईरीन ज्यूलियट क्यूरी (मैडम क्यूरी की नोबल पुरस्कार विजेता बेटी) जो पोलोनियम के एक बार के सेवन में ही जीवन से हाथ धो बैठी थी।
हालांकि ऐसा भी माना जा सकता है, फेफड़ों के कैंसर से मरने वाले ज्यादातर लोग अपने फेफड़ों में मौजूद पोलोनियम द्वारा उत्सर्जित अल्फा कणों के कारण उत्पन्न फेफड़ों के कैंसर से ही ग्रस्त हुए होंगे, जो शायद तम्बाकू के धुएं से उनके फेफड़ों तक पहुंचे हों।
रूस के सरकारी आंकड़ें बताते हैं कि रूस हर वर्ष करीब 80 ग्राम पोलोनियम बनाता है और उसका मुख्य खरीदार अमेरिका है। पोलोनियम से ज्यादा खतरनाक अमेरिकियम-241 है, जिसकी अर्ध आयु 450 वर्षों की है और यह खतरनाक मात्रा में हमारे घरों दफ्तरों के स्मोक डिटेक्टर (धुंए की पहचान करने वाला यंत्र) में भी है। फिर यह रेडियोएक्टिव पदार्थ तम्बाकू में भी है और शायद हमारे खाने में भी। पोलोनियम का उपयोग करने वाला मानव ही जब मानवता भूलने लगा है, तो इस दुर्लभ धातु के भी अमानवीय रूप सामने आने लगे हैं। आज हमें सोचना होगा कि कब तक हम धरती के प्राकृतिक संसाधनों का अपने ही नाश के लिए प्रयोग करते रहेंगे, वरना कल बहुत देर हो जाएगी।
लिट्विनेनको ने 1 नवंबर को एक जापानी रेस्त्रां में एक इतालवी व्यक्ति मारियो स्कारामैला के साथ खाना खाया और फिर अचानक उनकी तबियत खराब हो गई। 44 वर्षीय लिट्विनेनको की पत्नी मरीना रो अपने पति को तिल-तिल कर मरते हुए देख रही थी। हर इलाज बेकार था और हर 24 घंटे उसके पति की आयु दस वर्ष बढ़ा रहे थे। लिट्विनेनको के सर पर अब सुनहरे बाल नहीं थे, यहां तक कि भौंहें भी कम होती जा रहीं थी। न दर्द, न जख्म न कोई संक्रमण, बस धीरे-धीरे मौत की तरफ बढ़ता जीवन। पूरा शरीर एक 44 वर्ष के स्वस्थ व्यक्ति का न होकर करीब 100 साल के जर्जर व्यक्ति का लग रहा था और फिर तीन हफ्ते की असफल जंग के बाद एलेक्जैंडर लिट्विनेनको ने 23 नवंबर, 2006 को मौत के सामने हथियार डाल दिए। डॉक्टरों के अनुसार लिट्विनेनको रेडियोएक्टिव (रेडियोधर्मी) तत्व पोलोनियम 210 की विषाक्तता से ग्रस्त थे। स्कारामैला में भी रेडियोएक्टिविटी की विषाक्तता के लक्षण मिले हैं। वह भी अस्पताल में भर्ती हैं, अगर बच गए तो कैंसर होने की काफी संभावना है। इसके अलावा लिट्विनेनको की पत्नी मरीना में भी पोलोनियम के ट्रेस मिले पर उनके शरीर में घातक मात्रा नहीं है। इसके अलावा लिट्विनेनको के घर, उस होटल में जहां उनकी दो रूसियों से मुलाकात हुई थी, जापानी रेस्त्रां में बोरिस बेरोजविक्सी के दफ्तर में ग्रॉसवेनर स्ट्रीट स्थित सुरक्षा मुख्यालय में भी पोलोनियम 210 के विकिरण के प्रमाण मिले हैं।
चार हवाई जहाजों में भी पोलोनियम 210 होने के प्रमाण मिले हैं, जिनमें करीब 33 हजार व्यक्ति यात्रा कर चुके हैं। इन जहाजों को अब उड़ाया नहीं जा रहा और सभी यात्रियों का पता लगाकर उनकी जांच की जा रही है।
एलेक्जैंडर लिट्विनेनको को मौत की नींद सुलाने वाला जहर, पोलोनियम-210 (210 Po) की पहचान ब्रिटिश चिकित्सकों ने कर ली थी। पर फिर भी, उसके खतरनाक विकिरण को रोक पाने में वह असफल रहे।
पोलोनियम की खोज
पोलोनियम को शुरुआत में ‘रेडियम एफ’ नाम दिया गया था और इसकी खोज मशहूर वैज्ञानिक और नोबल पुरस्कार विजेता दंपति मैरी क्यूरी और उनके पति पियरे क्यूरी ने सन् 1898 में की थी। मैरी क्यूरी मूलतः पोलैंड की निवासी थीं और जब पोलोनियम की खोज हुई थी तो उस समय पोलैंड, रूस, पुरुशियाई, और आस्ट्रिया के कब्ज़े में था। इसलिए मैरी क्यूरी ने सोचा कि अगर इस तत्व का नाम उनके देश पोलैंड के नाम पर रख दिया जाएगा तो शायद दुनिया का ध्यान पोलैंड की गुलामी की ओर जाएगा। इस कारण इस नए खोजे गए तत्व का नाम ‘रेडियम एफ’ से बदलकर पोलैंड के सम्मान में ‘पोलोनियम’ रखा और प्रथम विश्व युद्ध के बाद सन् 1918 में पोलैंड एक आजाद देश बन गया।
इस तत्व की खोज तब हुई, जब क्यूरी दंपति पिचब्लेंड (खोदने पर मिली पथरीली सामग्री) की रेडियोएक्टिविटी (रेडियोधर्मिता) पर शोध कर रहे थे। उन्होंने पाया कि पिचब्लेंड में से दोनों रेडियोएक्टिव पदार्थ यानी यूरेनियम और थोरियम, अलग करने के बावजूद भी पिचब्लेंड, यूरेनियम और थोरियम से ज्यादा रेडियोएक्टिव था। इस नतीजे ने क्यूरी दंपति को और रेडियोएक्टिव तत्वों की खोज करने के लिए प्रेरित किया और इन्होंने पिचब्लेंड से पहले पोलोनियम और इसके कुछ वर्ष बाद रेडियम पृथक किया।
अल्फा एवं बीटा विकिरण
अल्फा विकिरण एक उच्च आयनीकृत कणों का विकिरण होता है, जिसकी भेदने की क्षमता सबसे कम होती है। अल्फा कणों में दो प्रोटोन और दो न्यूट्रॉन होते हैं, जो हीलियम के नाभिक जैसे कण में आपस में जुड़े होते हैं, इसलिए इन्हें He2+ लिखा जाता है। परमाणु की परमाणविक संख्या 2 के अनुसार कम हो जाती है क्योंकि परमाणु से 2 प्रोटोन निकल जाते हैं और नए तत्व का निर्माण होता है, उदाहरण के लिए अल्फा विघटन के कारण रेडियम, रोडोन गैस बन जाता है। अल्फा कणों की गति ज्यादा नहीं होती बल्कि सभी सामान्य प्रकार के विकरण में सबसे कम होती है क्योंकि इनका द्रव्यमान ज्यादा होता है यानी ज्यादा ऊर्जा अपने चार्ज (आवेश) और बड़े द्रव्यमान के कारण इन्हें एक पतला टिशू पेपर या फिर मानव शरीर की बाह्य त्वचा भी आसानी से अवशोषित कर सकते हैं। इसीलिए अल्फा उत्सर्जकों का फेफड़ों या शरीर में अवशोषित होना या खाने के साथ शरीर में जाना काफी खतरनाक होता है। बीटा विकिरण में इलेक्ट्रॉन होते हैं, जो एल्यूमीनियम प्लेट से रोके जा सकते हैं। गामा विकिरण और अंदर तक भेद सकते हैं। बीटा कण, पोटैशियम-40 जैसे कुछ रेडियोएक्टिव नाभिक से उत्सर्जित होते हैं जो उच्च ऊर्जा, उच्च गति वाले इलेक्ट्रॉन या पोजीट्रॉन होते हैं।
कितना है पोलोनियम?
पोलोनियम प्रकृति में पाया जाने वाला एक दुर्लभ एवं अत्यधिक रेडियोएक्टिव (रेडियोधर्मी) रासायनिक तत्व है जो Po के चिन्ह द्वारा दर्शाया जाता है और इसकी परमाणु संख्या 34 है। पोलोनियम की विरलता का पता इसी से लगाया जा सकता है कि यूरेनियम अयस्क के प्रति मीट्रिक टन में इसकी मात्रा करीब 100 ग्राम होती है। प्रकृति में जितनी रेडियम की मात्रा होती है, उसकी लगभग 0.2 प्रतिशत मात्रा पोलोनियम की होती है।
किसी भी ज्ञात तत्व में सर्वाधिक आइसोटोप यानी समस्थानिक, पोलोनियम के हैं और पोलोनियम के सभी आइसोटोप रेडियोएक्टिव हैं। पोलोनियम के 25 ज्ञात आइसोटोप हैं। इनमें 210Po यानी पोलोनियम 210, सबसे ज्यादा उपलब्ध है।
पोलोनियम 210 की हाफ लाइफ यानी अर्ध आयु (वह अवधि, जिसमें तत्व अपनी रेडियोधर्मिता की आधी क्षमता खो देता है), लगभग 138 दिनों की होती है। इसी तरह, पोलोनियम 209 (209Po) की अर्ध आयु 103 वर्ष तथा पोलोनियम 208 (208Po) की अर्ध आयु 2.9 वर्षों की होती है। पोलोनियम 209 और 208 को सीसे (Pb) या बिस्मथ (Bi) पर अल्फा, प्रोटॉन या ड्यूट्रॉन की साइक्लोट्रॉन में बारिश द्वारा भी बनाया जा सकता है। साइक्लोट्रॉन एक ऐसा उपकरण है जो परमाणविक कणों की गति बढ़ा सकता है यानी साइक्लोट्रॉन के उपयोग द्वारा बिस्मथ पर प्रोटॉन की बारिश करवा कर ज्यादा आयु वाले पोलोनियम के आइसोटोप बनाए जा सकते हैं।
1934 में अमेरिका में किए गए एक प्रयोग से यह सामने आया कि जब प्राकृतिक बिस्मथ (209Bi) पर न्यूट्रॉन की बारिश की जाती है तो 210Bi यानी बिस्मथ 210 बन जाता है, जो बीटा क्षय के कारण 210Po यानी पोलोनियम 210 में परिवर्तित हो जाता है। इस विधि द्वारा भी ‘न्यूक्लियर रिएक्टरों’ में पाए जाने वाले न्यूट्रॉन प्रवाह से भी कुछ मि.ग्रा. मात्रा में ही पोलोनियम तैयार किया जाने लगा है। हर वर्ष करीब 100 ग्राम पोलोनियम का उत्पादन किया जाता है, जिस कारण बहुत ही दुर्लभ तत्वों में इसकी गिनती होती है।
पोलोनियम 210 से असंख्य अल्फा कण निकलते हैं, जो किसी भी गाढ़े माध्यम में थोड़ी ही दूरी तक जा पाते हैं और रुकते ही यह अल्फा कण अपने में समाई ऊर्जा छोड़ देते हैं। पोलोनियम 210 के क्षय से इतनी ज्यादा ऊष्मा निकलती है (140 वाट प्रति ग्राम) की एक साधारण से दवाई वाले कैप्सूल में अगर आधा ग्राम पोलोनियम 210 भर दिया जाए तो इसका तापमान 500 डिग्री सेंटीग्रेड से भी ज्यादा पहुंच जाएगा। अपने इसी गुण के कारण पोलोनियम 210 का उपयोग एक हल्के ऊष्मा के स्रोत के रूप में कृत्रिम उपग्रह के ताप विद्युतीय सैलों में किया जाता है। चंद्रमा की सतह पर गए प्रत्येक लूनोखोड रोवर में पोलोनियम 210 को ऊष्मा के स्रोत के रूप में रखा गया था, जिसका काम चंद्रमा की ठंडी रातों में रोवर के अंदरूनी उपकरणों को गर्म रखना था। क्योंकि अल्फा कण पॉजिटिव चार्ज कण होते हैं, इसलिए पोलोनियम 210 का उपयोग विद्युत स्थैतिक (इलैक्ट्रो स्टेटिक) को निष्क्रिय करने के लिए किया जाता है। कुछ प्रति-स्थैतिक ब्रशों में पोलोनियम 210 की मात्रा 500 माइक्रोक्यूरी तक होती है। उदाहरण के लिए फोटोग्राफिक फिल्मों को डेवलप करने वाली लैब में इन ब्रशों का उपयोग किया जाता है। इसी तरह कपड़ा उद्योग, स्टील रोलिंग मिल्स आदि में भी पोलोनियम का उपयोग प्रति-स्थैतिक के रूप में किया जाता है।
सिगरेट के धुएं में पोलोनियम
1960 के दशक में एक अध्ययन से यह सामने आया कि सिगरेट में पोलोनियम की अच्छी-खासी मात्रा होती है। यूरेनियम के विघटित उत्पाद, प्राकृतिक रूप में मिट्टी में होते हैं, जिन्हें तम्बाकू का पौधा अवशोषित कर लेता है और पौधे में यह उत्पाद रेडियोएक्टिव पोलोनियम में विघटित हो जाते हैं। जिन क्षेत्रों में उच्च फास्फेट वाली खाद का अधिक प्रयोग होता है वहां यह परेशानी ज्यादा है क्योंकि खाद में मौजूद फास्फेट से यूरेनियम का ज्यादा जुड़ाव है। एक अनुसंधान से यह पता चला है कि सिगरेट का सेवन करने वाले लोग, औसतन 0.04 पिकोक्यूरी पोलोनियम 210 प्रति सिगरेट अपने में समा लेते हैं। इसके अलावा सिगरेट के हर कश के साथ टार, तम्बाकू, साइनाइड और कैंसर पैदा करने वाले बेंजोपाइरीन जैसे 100 से भी ज्यादा खतरनाक रसायन होते हैं। सिगरेट पीने वालों के द्वारा छोड़े गए धुएं से उनके साथ-साथ न पीने वाले भी प्रभावित होते हैं, शायद कुछ ज्यादा ही।
क्या बनाता है पोलोनियम को इतना खतरनाक जहर?
पोलोनियम 210, लगभग 138 दिनों की अर्ध आयु वाला एक जबरदस्त अल्फा उत्सर्जक है। पोलोनियम 210 की एक मि.ग्रा. मात्रा, रेडियम की 5 ग्राम मात्रा में से निकलने वाले अल्फा कणों के बराबर अल्फा कण उत्सर्जित करती है। पोलोनियम की कुछ क्यूरी (1 क्यूरी बराबर 37 गिगाबैक्यूरल) मात्रा एक नीली चमक पैदा करती है, जो आसपास की हवा के उत्तेजित होने से होता है। क्योंकि पोलोनियम 210 की अर्ध आयु काफी कम होती है, इसलिए एक ग्राम पोलोनियम 210 से 140 वाट की ऊर्जा प्राप्त होती है। लगभग सभी अल्फा विकिरण अपने ठोस आवरण में रुक जाते हैं और ऊर्जा छोड़ देते हैं।
तनुकृत अम्लों में पोलोनियम 210 आसानी से घुल जाता है और क्षारीय द्रव्य मे यह मुश्किल से घुल पाता है। पोलोनियम 210 का गलनांक (melting point) काफी कम होता है और यह काफी उड़नशील धातु है। करीब 55 डिग्री सेंटीग्रेड तापमान पर 45 घंटों में 50 प्रतिशत धातु वाष्पित हो जाती है।
 एक अध्ययन में ऐसा भी सामने आया है कि सूक्ष्मजीव भी पोलोनियम को इस्तेमाल करते हैं। इसलिए प्राणियों और वनस्पतियों में भी पोलोनियम मामूली मात्रा में पाया जा सकता है। अगर पोलोनियम के ठोस आकार की चर्चा करें तो यह एक घन के रूप में होता है, जिसमें परमाणुओं के बीच की दूरी 3.352 आर्मस्ट्रांग होती है (परमाणुओं के बीच की दूरी आर्मस्ट्रांग में नापी जाती है)।
एक अध्ययन में ऐसा भी सामने आया है कि सूक्ष्मजीव भी पोलोनियम को इस्तेमाल करते हैं। इसलिए प्राणियों और वनस्पतियों में भी पोलोनियम मामूली मात्रा में पाया जा सकता है। अगर पोलोनियम के ठोस आकार की चर्चा करें तो यह एक घन के रूप में होता है, जिसमें परमाणुओं के बीच की दूरी 3.352 आर्मस्ट्रांग होती है (परमाणुओं के बीच की दूरी आर्मस्ट्रांग में नापी जाती है)।पोलोनियम की नई भूमिका
द्वितीय विश्व युद्ध के दौरान जापान के नागासाकी पर गिराए गए परमाणु बम में ‘ट्रिगर’ के रूप में पोलोनियम 210 का ही उपयोग किया गया था, परंतु इसकी एक नई भूमिका अभी-अभी सामने आई है, यह है ‘जहर’ के रूप में पोलोनियम का उपयोग।
पोलोनियम एक अत्यधिक रेडियोएक्टिविटी वाला और रासायनिक रूप से अत्यधिक विषाक्त तत्व है और इसका सुरक्षित रखरखाव काफी मुश्किल है। पोलोनियम की माइक्रोग्राम (1 ग्रा. का हजारवां हिस्सा) मात्रा को भी सहेजना काफी खतरनाक है। इसके लिए विशेष उपकरणों और सख्त निर्देशका का पालन करना आवश्यक है। पोलोनियम द्वारा उत्सर्जित अल्फा कणों द्वारा जैविक ऊतकों को नुकसान पहुंचाना बहुत आसान है। अगर पोलोनियम का सेवन किया गया हो या सूंघा गया हो या किसी जख्म के द्वारा उसे उवशोषित किया गया हो तो पोलोनियम हमारी त्वचा की बाहरी परत (ऐपिडर्मिस) के पार नहीं जा सकता, क्योंकि इसमें मृत कोशिकाएं होती हैं जो हमारी रक्षा करती हैं।
एक बार अगर पोलोनियम 210 हमारे शरीर में पहुंच गया तो यह अपना खतरनाक रूप दिखाने लगता है। कोशिकाओं के डीएनए में बदलाव, जो कई कैंसरों को जन्म दे सकता है, से लेकर ऊतकों की संरचना तक को भी गड़बड़ा सकता है। अगर पोलोनियम की लगभग 50 नैनोग्राम (1 नैनोग्राम = 1 ग्राम का एक अरबवां हिस्सा यानी 10-9 ग्राम) मात्रा अगर खाई जाए और करीब 10 नैनोग्राम मात्रा सूंघी जाए तो यह जीवन के लिए घातक मात्रा है, जो हर पल मौत की ओर ले जाएगी। इस सिद्धांत को अगर सही मानें तो पोलोनियम 210 की 1 ग्राम मात्रा 10 करोड़ लोगों को अपनी विषाक्तता का शिकार बना सकती है।
हमारे शरीर की पोलोनियम 210 को बर्दाश्त करने की अधिकतम सीमा 0.03 माइक्रो क्यूरी है। इसका मतलब हुआ कि एक ऐसा कण जिसका वजन 6.8x10-12 ग्राम हुआ। अगर वजन के अनुसार लें तो पोलोनियम 210, हाइड्रोसाइनिक एसिड (साइनाइड जो सबसे घातक जहर माना जाता है) से 2.5X10 के पावर 11 गुना (यानी खरबों गुना) ज्यादा विषाक्त है।
पोलोनियम का जहर के रूप में पहली बार उपयोग एलेक्जैंडर लिट्विनेनको पर ही किया गया है, पर पोलोनियम की विषाक्तता की पहली शिकार थी, 1950 के दशक में ईरीन ज्यूलियट क्यूरी (मैडम क्यूरी की नोबल पुरस्कार विजेता बेटी) जो पोलोनियम के एक बार के सेवन में ही जीवन से हाथ धो बैठी थी।
हालांकि ऐसा भी माना जा सकता है, फेफड़ों के कैंसर से मरने वाले ज्यादातर लोग अपने फेफड़ों में मौजूद पोलोनियम द्वारा उत्सर्जित अल्फा कणों के कारण उत्पन्न फेफड़ों के कैंसर से ही ग्रस्त हुए होंगे, जो शायद तम्बाकू के धुएं से उनके फेफड़ों तक पहुंचे हों।
रूस के सरकारी आंकड़ें बताते हैं कि रूस हर वर्ष करीब 80 ग्राम पोलोनियम बनाता है और उसका मुख्य खरीदार अमेरिका है। पोलोनियम से ज्यादा खतरनाक अमेरिकियम-241 है, जिसकी अर्ध आयु 450 वर्षों की है और यह खतरनाक मात्रा में हमारे घरों दफ्तरों के स्मोक डिटेक्टर (धुंए की पहचान करने वाला यंत्र) में भी है। फिर यह रेडियोएक्टिव पदार्थ तम्बाकू में भी है और शायद हमारे खाने में भी। पोलोनियम का उपयोग करने वाला मानव ही जब मानवता भूलने लगा है, तो इस दुर्लभ धातु के भी अमानवीय रूप सामने आने लगे हैं। आज हमें सोचना होगा कि कब तक हम धरती के प्राकृतिक संसाधनों का अपने ही नाश के लिए प्रयोग करते रहेंगे, वरना कल बहुत देर हो जाएगी।
Path Alias
/articles/paolaonaiyama-kai-kahaanai
Post By: admin